Electrolisis del Agua
Electrolisis del Agua
El agua (H2O), por medio de la energía suministrada por una batería, se puede disociar en moléculas diatómicas de hidrógeno (H2) y oxígeno (O2). Este proceso es un buen ejemplo de la aplicación de los cuatro potenciales termodinámicos.
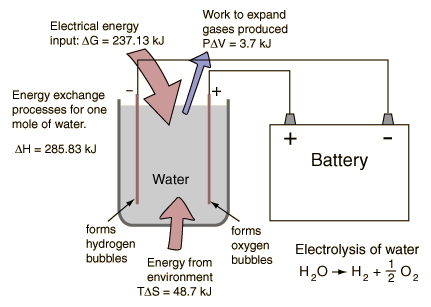 La electrólisis de una mol de agua, produce una mol de gas hidrógeno y media mol de gas oxígeno en sus formas normales diatómicas. Un detallado análisis del proceso, muestra el uso de los potenciales termodinámicos y la primera ley de la termodinámica. Se supone que este proceso se lleva a 298ºK., y una atmósfera de presión, y los valores relevantes se han tomado de una tabla de propiedades termodinámicas.
La electrólisis de una mol de agua, produce una mol de gas hidrógeno y media mol de gas oxígeno en sus formas normales diatómicas. Un detallado análisis del proceso, muestra el uso de los potenciales termodinámicos y la primera ley de la termodinámica. Se supone que este proceso se lleva a 298ºK., y una atmósfera de presión, y los valores relevantes se han tomado de una tabla de propiedades termodinámicas.
| Cantidad |
H2O
|
H2
|
0,5 O2
|
Cambio
|
| Entalpía |
-285,83 kJ
|
0
|
0
|
ΔH = 285,83 kJ
|
| Entropía |
69,91 J/K
|
130,68 J/K
|
0,5 x 205,14 J/K
|
TΔS = 48,7 kJ
|
El proceso debe proveer la energía para la disociación, mas la energía para expandir los gases producidos. Ambos están incluidos en el cambio deentalpía de la tabla de arriba. A la temperatura de 298ºK y una atmósfera de presión, el trabajo del sistema es
W = PΔV = (101,3 x 103 Pa)(1,5 moles)(22,4 x 10-3 m3/mol)(298K/273K) = 3715 J
Como la entalpía H= U+PV, el cambio en la energía interna U es por tanto
ΔU = ΔH - PΔV = 285,83 kJ - 3,72 kJ = 282,1 kJ
Este cambio en la energía interna, debe estar acompañado por la expansión de los gases producidos, por lo que el cambio en la entalpía representa la energía necesaria para llevar a cabo la electrólisis. Sin embargo, no es necesario poner este monto total, en forma de energía eléctrica. Puesto que laentropía aumenta en el proceso de disociación, la cantidad TΔS puede ser proporionada por el medio ambiente a la temperatura T. La cantidad que debe ser suministrada por la batería, es realmente el cambio en la energía libre de Gibbs:
ΔG = ΔH - TΔS = 285.83 kJ - 48.7 kJ = 237,1 kJ
Como el resultado del proceso de electrólisis es un aumento de la entropía, el medio ambiente "ayuda" al proceso contribuyendo con una cantidad TΔS. La utilidad de la energía libre de Gibbs, consiste en indicarnos que cantidad de otras formas de energía, se deben suministrar para que se produzca el proceso.

No hay comentarios:
Publicar un comentario